
《世界临床药物》

(人民日报健康客户端 孔天骄)3月18日,人民日报健康客户端从国家药监局药品审评中心(CDE)17日发布的临床临床实验默示许可栏及企业官网公告发现,有多达7款药物临床获批临床,其中,北恒生物CTA101UCAR-T细胞注射液获批临床、正大天晴TQB3820片获得临床试验默示许可、阿斯利康注射用Monalizumab、Oleclumab Injection获批等。
在这些获批临床的相关药物中,其中5款为抗肿瘤药物,其他两款药物涉及尘肺病、肾病相关治疗。
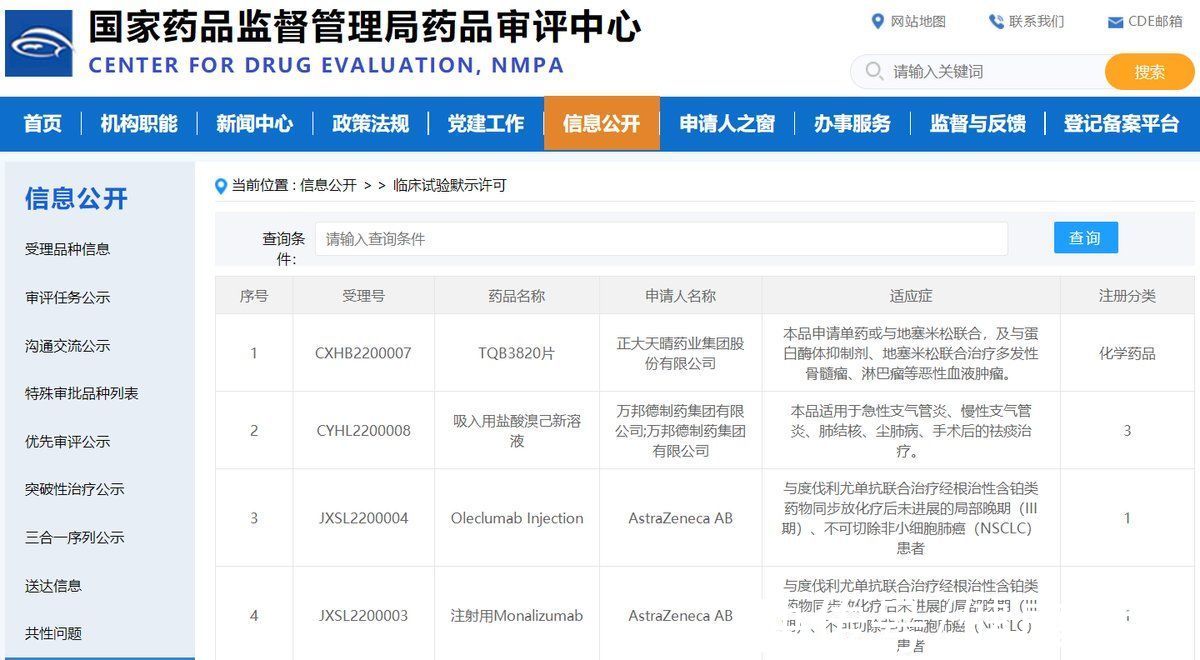
3月17日,国家药监局药品审评中心官网显示,正大天晴TQB3820片获得临床试验默示许可。申请适应症为单药或与地塞米松联合,及与蛋白酶体抑制剂、地塞米松联合治疗多发性骨髓瘤、淋巴瘤等恶性血液肿瘤。
CDE显示,复宏汉霖自主开发的重组人源抗PD-L1与抗TIGIT双特异性抗体注射液HLX301获国家药监局批准在中国开展1期临床研究,拟用于晚期肿瘤的治疗。目前,全球范围内尚无同类靶向PD-1/L1和TIGIT的双特异性抗体获批上市。此外,北恒生物自主研发的CTA101 UCAR-T细胞注射液产品正式获得国家药监局的临床试验默示许可。CTA101是CDE批准的国内首款“现货型”UCAR-T细胞治疗产品,用于治疗成人复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)。
CDE显示,阿斯利康注射用Monalizumab、Oleclumab Injection获批临床,这两种药品适应症都为与度伐利尤单抗联合治疗经根治性含铂类药物同步放化疗后未进展的局部晚期(III期)、不可切除非小细胞肺癌(NSCLC)患者。天演药业宣布,FDA批准天演进行其抗CTLA-4单克隆抗体ADG126与抗PD-1抗体帕博利珠单抗(pembrolizumab)联合疗法的Ib/II期新药临床试验。该全球试验将于美国及亚太地区(APAC)多个临床中心对晚期/转移性实体瘤患者进行评估。
此外,CDE官网显示,万邦德制药吸入用盐酸溴己新溶液获批临床。该药品适用于急性支气管炎、慢性支气管炎、肺结核、尘肺病、手术后的祛痰治疗。中国药物临床试验登记与信息公示平台显示,云顶新耀公司已在中国启动一项Nefecon治疗原发性IgA肾病患者的3期临床试验。
上一篇:广生堂子公司一创新药Ⅰ期临床首例受试者成功
下一篇:没有了