
《世界临床药物》

(健康时报记者 赵萌萌)10月22日,国家药监局药品审评中心最新公示显示,诺华在中国递交的OAV101注射液(Zolgensma)的临床试验申请已获得受理。Zolgensma为全球首个治疗脊髓性肌萎缩症的基因疗法,定价212.5万美元(折合人民币约1358万元),也被称为“史上最贵药物”。目前Zolgensma已在40多个国家获批。
健康时报记者根据美国药品价格跟踪网站GoodRx数据盘点了2021年全球最贵药物10款药物。
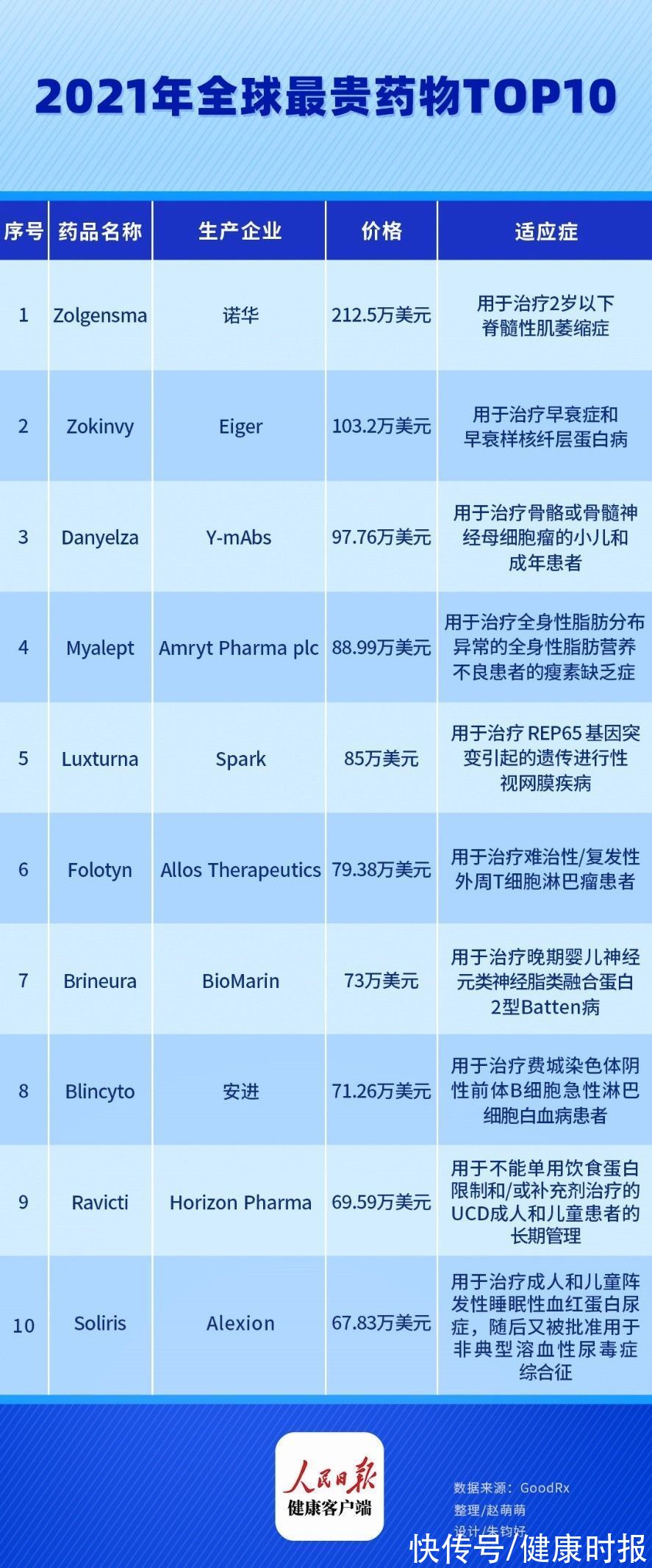
1、 Zolgensma
Zolgensma于2019年5月获FDA批准,用于治疗2岁以下脊髓性肌萎缩症,定价212.5万美元,不过Zolgensma只需注射一次即可。目前Zolgensma已经在全球近40个国家和地区获批,2020年实现9.2亿美元销售收入,涨幅达到150%。2020年5月,Zolgensma被纳入日本医保,患者只需支付30%费用,今年3月Zolgensma被纳入英国国家医疗服务体系。
2、Zokinvy
Eiger的Zokinvy于2020年11月获FDA批准上市,是一种首创的、口服法尼基转移酶抑制剂(FTI),用于治疗早衰症和早衰样核纤层蛋白病,也是首个获批用于治疗HGPS的药物。Zokinvy是榜单的新增成员,年度使用费约为103.2万美元,为提高患者的支付能力,Eiger实施了ONECARE计划,可以为患者提供保险和财务支持。
3、Danyelza
纽约Y-mAbs制药公司的Danyelza于2020年11月获FDA加速批准上市,用于治疗骨骼或骨髓神经母细胞瘤的小儿和成年患者。Danyelza同样也是该榜单的新晋成员,每瓶价格为美元,年度使用费约为97.8万美元。目前,与Danyelza相同靶点和适应症的EUSA Pharma的迪妥昔单抗已于2017年获EMA批准上市,其在2020年的销售额突破1亿美元。在国内,2020 年1月EUSA与百济神州就该药在大中华地区达成独家开发和商业化协议。
4、Myalept
由Amryt研发的Myalept于2014年2月获得FDA批准上市,用于治疗全身性脂肪分布异常的全身性脂肪营养不良患者的瘦素缺乏症。Myalept是首个获批用于治疗该罕见疾病的药物,也是控制该病的唯一治疗方法。基于其无可替代性,Myalept价格上涨,从原先得每月的美元增加到今年2月得美元,年度使用费达到88.99万美元。
5、Luxturna
Spark的基因疗法Luxturna于2017年底获得FDA批准上市,用于治疗 REP65 基因突变引起的遗传进行性视网膜疾病。Luxturna是全球首款治疗眼科疾病的基因疗法,以AAV为载体,将正常的RPE65基因直接递送到视网膜细胞中,使视网膜细胞重新获得合成全反式规黄酯异构酶的能力,患者只需单次注射一支可即可达到治疗的效果。Luxturna的每支价格42.5万美元,双眼治疗费85万美元。不过,近年来针对遗传性视网膜营养不良相关药物的研发正在增加,已有多款处于临床后期。
6、Folotyn
Allos Therapeutics研发的Folotyn于2009年9月获FDA批准上市,用于治疗难治性/复发性外周T细胞淋巴瘤患者,也是首个用于治疗PTCL的二氢叶酸还原酶抑制剂。Folotyn每瓶标价5880美元,年度使用费为79.38万美元。2020年8月,Folotyn在中国获批,成为继西达本胺后国内上市的第2款外周T细胞淋巴瘤新药。
7 、Brineura
BioMarin的First-in-class酶替代疗法Brineura于2017年4月获FDA批准上市,用于治疗晚期婴儿神经元类神经脂类融合蛋白2型Batten病。治疗中需通过特殊手术植入储存器和导管将Brineura输送至患者脑脊髓液达到治疗的目的。由于缺少市场竞争,今年1月Brineura的价格再次调高,增长2.14%至美元,其年度花费也因此达到了约73万美元。
8、Blincyto
安进的Blincyto于2014年12月获FDA批准上市,用于治疗费城染色体阴性前体B细胞急性淋巴细胞白血病患者。Blincyto是全球首个也是唯一一个获批的CD19-CD3双特异性T细胞衔接免疫疗法,采用周期给药,在每个阶段,患者需要使用不同数量的药物,但通常每年需要使用约168瓶。今年1月,Blincyto的定价上涨5.89%,达到每瓶4242美元,每年花费达到71.26万美元。
9 、Ravicti
Horizon Pharma的Ravicti于2018年12月获FDA批准上市,用于不能单用饮食蛋白限制和/或补充剂治疗的UCD成人和儿童患者的长期管理。对比此前的苯丁酸钠,Ravicti提高了脂溶性,且为无气味、无味道的油状液体,在感官体验和剂量方面都具有较好的优势。2021年1月,Ravicti的标价上涨4.8%,至每瓶5273美元,年度使用费达69.59万美元。
10、Soliris
Alexion的Soliris于2007年3月获得FDA批准上市,用于治疗成人和儿童阵发性睡眠性血红蛋白尿症(PNH),随后又被批准用于非典型溶血性尿毒症综合征(aHUS)。Soliris为首创的补体抑制剂,其给药方案可能根据患者的年龄和的疾病而不同,但大多数患者需要每2周1200毫克的维持剂量,年度使用费约为67.83万美元。
上一篇:江苏恒瑞医药股份有限公司 关于获得药物临床试
下一篇:没有了